EMEND 125 mg, poudre pour suspension buvable, boîte de 1 sachet ( 2 pipettes, godet) de 125 mg
Dernière révision : 29/08/2022
Taux de TVA : 2.1%
Prix de vente : 25,65 €
Taux remboursement SS : 65%
Base remboursement SS : 25,65 €
Laboratoire exploitant : MSD FRANCE
Prévention des nausées et des vomissements associés à des chimiothérapies anticancéreuses hautement et moyennement émétisantes chez les enfants et les nourrissons âgés de 6 mois à moins de 12 ans.
EMEND poudre pour suspension buvable est administré dans le cadre d'un schéma thérapeutique (voir rubrique Posologie et mode d'administration).
Hypersensibilité au principe actif ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Co-administration avec le pimozide, la terfénadine, l'astémizole ou le cisapride (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Insuffisants hépatiques modérés à sévères
Les
données chez les patients ayant une insuffisance hépatique modérée sont
limitées, et aucune donnée chez les patients ayant une insuffisance
hépatique sévère n'est disponible. EMEND doit être utilisé avec
précaution chez ces patients (voir rubrique Propriétés pharmacocinétiques).
Interactions avec le CYP3A4
EMEND
doit être utilisé avec précaution chez les patients prenant de façon
concomitante par voie orale des substances actives métabolisées
principalement par le CYP3A4 et ayant une marge thérapeutique étroite,
telles que la ciclosporine, le tacrolimus, le sirolimus, l'évérolimus,
l'alfentanil, les alcaloïdes dérivés de l'ergot de seigle, le fentanyl
et la quinidine (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
De plus, l'administration concomitante avec l'irinotécan doit être
envisagée avec une prudence toute particulière, cette association
pouvant majorer sa toxicité.
Co-administration avec la warfarine (un substrat du CYP2C9)
Chez
les patients traités au long cours par la warfarine, l'INR
(International Normalised Ratio) doit être étroitement surveillé au
cours du traitement par EMEND et pendant 14 jours après chaque cure de
3 jours d'EMEND (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Co-administration avec les contraceptifs hormonaux
L'efficacité
des contraceptifs hormonaux peut être réduite pendant l'administration
d'EMEND et au cours des 28 jours qui la suivent. Des méthodes
alternatives de contraception non hormonale doivent être utilisées au
cours du traitement par EMEND et pendant les 2 mois qui suivent la
dernière prise d'EMEND (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Excipients
EMEND,
poudre pour suspension buvable contient du saccharose et du lactose.
Son utilisation est déconseillée chez les patients présentant des
problèmes héréditaires rares d'intolérance au fructose ou au galactose,
un syndrome de malabsorption du glucose et du galactose, un déficit
total en lactase ou un déficit en sucrase/isomaltase.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par sachet, c'est-à-dire qu'il est essentiellement « sans sodium ».
Résumé du profil de sécurité
Le
profil de sécurité de l'aprépitant a été évalué chez environ 6 500
adultes dans plus de 50 essais cliniques et chez 184 enfants et
adolescents dans 2 essais cliniques pédiatriques contrôlés.
Les effets indésirables les plus fréquents, rapportés avec une incidence supérieure chez les patients adultes traités par l'aprépitant comparés à ceux recevant un traitement standard dans le cadre d'une Chimiothérapie Hautement Emétisante (CHE), ont été : hoquet (4,6 % versus 2,9 %), élévation de l'alanine aminotransférase (ALAT) (2,8 % versus 1,1 %), dyspepsie (2,6 % versus 2,0 %), constipation (2,4 % versus 2,0 %), céphalées (2,0 % versus 1,8 %) et diminution de l'appétit (2,0 % versus 0,5 %). L'effet indésirable le plus fréquent, rapporté avec une incidence supérieure chez les patients adultes traités par l'aprépitant comparés à ceux recevant un traitement standard dans le cadre d'une Chimiothérapie Moyennement Emétisante (CME), a été la fatigue (1,4 % versus 0,9 %).
Les effets indésirables les plus fréquents, rapportés avec une incidence supérieure chez les patients pédiatriques traités par l'aprépitant comparés à ceux recevant un traitement contrôle pendant leur chimiothérapie anticancéreuse émétisante, ont été : hoquet (3,3 % versus 0,0 %) et bouffées congestives (1,1 % versus 0,0 %).
Liste des effets indésirables présentée sous forme de tableau
Les
effets indésirables suivants ont été observés avec une incidence
supérieure chez les patients traités par l'aprépitant comparés à ceux
recevant un traitement standard d'après une analyse poolée des études
cliniques réalisées avec des chimiothérapies hautement et moyennement
émétisantes (CHE et CME), ou depuis la mise sur le marché. Les
catégories de fréquences mentionnées dans le tableau sont basées sur
les études menées chez les adultes ; les fréquences observées lors des
études pédiatriques ont été similaires ou inférieures, sauf mention
dans le tableau. Certains effets indésirables moins fréquents dans la
population adulte n'ont pas été observés lors des études pédiatriques.
Définition des fréquences : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) et très rare (<1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
| Classes de systèmes d'organes | Effet indésirable | Fréquence |
| Infections et infestations | candidose, infection à staphylocoques | rare |
| Affections hématologiques et du système lymphatique | neutropénie fébrile, anémie | peu fréquent |
| Affections du système immunitaire | réactions d'hypersensibilité incluant réactions anaphylactiques | fréquence indéterminée |
| Troubles du métabolisme et de la nutrition | diminution de l'appétit | fréquent |
| polydipsie | rare | |
| Affections psychiatriques | anxiété | peu fréquent |
| Classes de systèmes d'organes | Effet indésirable | Fréquence |
| désorientation, humeur euphorique | rare | |
| Affections du système nerveux | céphalées | fréquent |
| étourdissements, somnolence | peu fréquent | |
| troubles cognitifs, léthargie, dysgueusie | rare | |
| Affections oculaires | conjonctivite | rare |
| Affections de l'oreille et du labyrinthe | acouphènes | rare |
| Affections cardiaques | palpitations | peu fréquent |
| bradycardie, troubles cardiovasculaires | rare | |
| Affections vasculaires | bouffées de chaleur/bouffées congestives | peu fréquent |
| Affections respiratoires, thoraciques et médiastinales | hoquet | fréquent |
| douleur oro-pharyngée, éternuements, toux, écoulement rétro-nasal, irritation de la gorge | rare | |
| Affections gastro-intestinales | constipation, dyspepsie | fréquent |
| éructation, nausées†, vomissements†, reflux gastro-œsophagien, douleur abdominale, bouche sèche, flatulence | peu fréquent | |
| perforation d'ulcère duodénal, stomatite, distension abdominale, selles dures, colite neutropénique | rare | |
| Affections de la peau et du tissu sous-cutané | rash, acné | peu fréquent |
| réaction de photosensibilité, hyperhydrose, séborrhée, lésions cutanées, rash pruritique, syndrome de Stevens-Johnson/syndrome de Lyell | rare | |
| prurit, urticaire | fréquence indéterminée | |
| Affections musculo- squelettiques et systémiques | faiblesse musculaire, spasmes musculaires | rare |
| Affections du rein et des voies urinaires | dysurie | peu fréquent |
| pollakiurie | rare | |
| Troubles généraux et anomalies au site d'administration | fatigue | fréquent |
| asthénie, malaise | peu fréquent | |
| œdème, gêne thoracique, trouble de la démarche | rare | |
| Investigations | élévation des ALAT | fréquent |
| élévation des ASAT, élévation des phosphatases alcalines sanguines | peu fréquent | |
| présence de globules rouges dans les urines, diminution du sodium sanguin, perte de poids, diminution du nombre de neutrophiles, présence de glucose dans les urines, augmentation de la diurèse | rare |
Description de certains effets indésirables
Les
profils des effets indésirables observés chez les adultes lors de
l'extension à des cycles multiples d'études dans le cadre de
chimiothérapies hautement et moyennement émétisantes (CHE et CME),
allant jusqu'à 6 cycles supplémentaires de chimiothérapie, ont été
généralement similaires à ceux observés au cours du cycle 1.
Dans une étude clinique supplémentaire contrôlée versus comparateur actif, réalisée chez 1 169 patients recevant de l'aprépitant et une chimiothérapie hautement émétisante (CHE), le profil des effets indésirables a été généralement similaire à celui observé au cours des autres études réalisées avec l'aprépitant dans le cadre de chimiothérapies hautement émétisantes (CHE).
Etudes non NVIC
D'autres
effets indésirables ont été rapportés chez des patients adultes traités
par une dose unique de 40 mg d'aprépitant pour des nausées et
vomissements post-opératoires (NVPO) avec une incidence supérieure à
celle observée chez les patients traités par l'ondansétron : douleur
abdominale haute, bruits intestinaux anormaux, constipation*,
dysarthrie, dyspnée, hypoesthésie, insomnie, myosis, nausées, troubles
sensoriels, gêne stomacale, subiléus*, baisse de l'acuité visuelle,
respiration sifflante.
* rapporté chez des patients prenant une plus forte dose d'aprépitant
Déclaration des effets indésirables suspectés
La
déclaration des effets indésirables suspectés après autorisation du
médicament est importante. Elle permet une surveillance continue du
rapport bénéfice/risque du médicament. Les professionnels de santé
déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
ARRETER LE TRAITEMENT ET CONSULTER IMMEDIATEMENT LE MEDECIN en cas de :
- Urticaire.
- Eruption cutanée.
- Démangeaisons.
- Difficultés à respirer ou à avaler.
EVITER la prise de préparations à base de plantes contenant du millepertuis (Hypericum perforatum).
PRUDENCE en cas de pratique de vélo ou d'utilisation de machines (étourdissements, fatigue).
CONTRACEPTION chez les hommes et les femmes : l'efficacité des contraceptifs hormonaux peut être réduite pendant l'administration de ce traitement et au cours des 28 jours qui la suivent. Une méthode de contraception alternative ou non hormonale complémentaire doit être utilisée pendant la prise d'aprépitant et pendant les 2 mois qui suivent la dernière prise de ce traitement.
- Urticaire.
- Eruption cutanée.
- Démangeaisons.
- Difficultés à respirer ou à avaler.
EVITER la prise de préparations à base de plantes contenant du millepertuis (Hypericum perforatum).
PRUDENCE en cas de pratique de vélo ou d'utilisation de machines (étourdissements, fatigue).
CONTRACEPTION chez les hommes et les femmes : l'efficacité des contraceptifs hormonaux peut être réduite pendant l'administration de ce traitement et au cours des 28 jours qui la suivent. Une méthode de contraception alternative ou non hormonale complémentaire doit être utilisée pendant la prise d'aprépitant et pendant les 2 mois qui suivent la dernière prise de ce traitement.
Contraception chez les hommes et les femmes
L'efficacité des contraceptifs hormonaux peut être réduite pendant l'administration d'EMEND et au cours
des 28 jours qui la suivent. Des méthodes alternatives de contraception
non hormonale doivent être utilisées au cours du traitement par EMEND
et pendant les 2 mois qui suivent la dernière prised'EM END (voir rubriques Mises en garde spéciales et précautions d'emploi et Interactions avec d'autres médicaments et autres formes d'interactions).
Grossesse
Il n'y a pas de données cliniques disponibles sur l'utilisation de
l'aprépitant chez la femme enceinte. La toxicité potentielle de
l'aprépitant sur la reproduction n'a pas été complètement décrite, car les niveaux d'exposition supérieurs à ceux obtenus chez l'homme en thérapeutique à la dose de 125 mg/80 mg n'ont pu être atteints dans les études chez l'animal. Ces études n'ont pas mis en évidence d'ef ets délétères directs ou indirects sur la grossesse, le développement embryonnaire ou fœtal, l'accouchement ou le développement post-natal (voir rubrique Données de sécurité préclinique).
Les effets potentiels des altérations de la régulation de la
neurokinine sur la reproduction ne sont pas connus. EMEND ne doit pas
être utilisé au cours de la grossesse sauf en cas de nécessité absolue.
Allaitement
L'aprépitant est excrété dans le lait des rates allaitantes. On ne sait pas si l'aprépitant est excrété dans le lait maternel humain ; par conséquent, il n'est pas recommandé d'allaiter au cours d'un traitement par EMEND.
Fertilité
Les effets potentiels de l'aprépitant sur la fertilité n'ont pas été
pleinement définis car les niveaux d'exposition supérieurs à
l'exposition chez l'homme n'ont pu être atteints dans les études chez l'animal. Ces études de fertilité n'ont pas mis en évidence d'ef ets délétères directs ou indirects sur la procréation,
la fertilité, le développement embryonnaire ou fœtal, ou le nombre de
spermatozoïdes et leur motilité (voir rubrique Données de sécurité préclinique).
L'aprépitant (125 mg/80 mg) est un substrat, un inhibiteur modéré et un inducteur du CYP3A4. L'aprépitant est également un inducteur du CYP2C9. Au cours du traitement par EMEND, le CYP3A4 est inhibé. Après la fin du traitement, EMEND entraîne une induction transitoire légère du CYP2C9, du CYP3A4 et de la glucuronidation. L'aprépitant ne semble pas interagir avec le transporteur de la glycoprotéine P comme le suggère l'absence d'interaction de l'aprépitant avec la digoxine.
Effet de l'aprépitant sur la pharmacocinétique d'autres substances actives
Inhibition du CYP3A4
En
tant qu'inhibiteur modéré du CYP3A4, l'aprépitant (125 mg/80 mg) peut
entraîner une élévation des concentrations plasmatiques des substances
actives administrées de façon concomitante et qui sont métabolisées par
le CYP3A4. L'exposition totale de substrats du CYP3A4 administrés par
voie orale peut augmenter jusqu'à 3 fois environ au cours du traitement
de 3 jours par EMEND ; l'effet attendu de l'aprépitant sur les
concentrations plasmatiques des substrats du CYP3A4 administrés par
voie intraveineuse est moindre. EMEND ne doit pas être administré de
façon concomitante avec le pimozide, la terfénadine, l'astémizole ou le
cisapride (voir rubrique Contre-indications). L'inhibition du
CYP3A4 par l'aprépitant pourrait entraîner une élévation des
concentrations plasmatiques de ces substances actives, susceptible de
provoquer des réactions graves ou de mettre en jeu le pronostic vital.
La prudence s'impose lors de la co-administration d'EMEND et de
substances actives administrées par voie orale, métabolisées
principalement par le CYP3A4 et ayant une marge thérapeutique étroite,
telles que la ciclosporine, le tacrolimus, le sirolimus, l'évérolimus,
l'alfentanil, la diergotamine, l'ergotamine, le fentanyl et la
quinidine (voir rubrique Mises en garde et précautions d'emploi).
Corticostéroïdes
Dexaméthasone
: La dose orale habituelle de dexaméthasone doit être réduite d'environ
50 % en cas de co-administration avec EMEND selon le schéma posologique
de 125 mg/80 mg. La dose de dexaméthasone au cours des essais cliniques
portant sur les nausées et vomissements induits par une chimiothérapie
(NVIC) a été choisie en tenant compte des interactions entre les
substances actives (voir rubrique Posologie et mode d'administration).
L'administration d'EMEND 125 mg en association à 20 mg de dexaméthasone
par voie orale à J1, et l'administration d'EMEND 80 mg/jour en
association à 8 mg de dexaméthasone par voie orale de J2 à J5, a
entraîné une élévation de l'ASC de la dexaméthasone, un substrat du
CYP3A4, de 2,2 fois à J1 et J5.
Méthylprednisolone : La dose habituelle de méthylprednisolone administrée par voie intraveineuse doit être réduite d'environ 25 %, et la dose orale habituelle de méthylprednisolone doit être réduite d'environ 50 % en cas de co-administration avec EMEND selon le schéma posologique de 125 mg/80 mg. L'administration d'EMEND selon le schéma posologique de 125 mg à J1 et 80 mg/jour à J2 et J3, a augmenté l'ASC de la méthylprednisolone, un substrat du CYP3A4, de 1,3 fois à J1 et de 2,5 fois à J3, lors de la co-administration de 125 mg de méthylprednisolone par voie intraveineuse à J1 et de 40 mg par voie orale à J2 et J3.
Au cours d'un traitement continu avec la méthylprednisolone, l'ASC de la méthylprednisolone peut diminuer ultérieurement dans les 2 semaines qui suivent l'initiation du traitement par EMEND, à cause de l'effet inducteur de l'aprépitant sur le CYP3A4. On peut s'attendre à ce que cet effet soit plus prononcé avec la méthylprednisolone administrée par voie orale.
Médicaments chimiothérapeutiques
Lors
d'études de pharmacocinétique, l'administration d'EMEND à la posologie
de 125 mg à J1 et de 80 mg/jour à J2 et J3, n'a pas modifié la
pharmacocinétique du docétaxel administré par voie intraveineuse à J1
ou de la vinorelbine administrée par voie intraveineuse à J1 ou J8.
L'effet d'EMEND sur la pharmacocinétique des substrats du CYP3A4
administrés par voie orale étant supérieur à celui sur la
pharmacocinétique des substrats du CYP3A4 administrés par voie
intraveineuse, une interaction avec les médicaments
chimiothérapeutiques administrés par voie orale et métabolisés
principalement ou partiellement par le CYP3A4 (par exemple,
l'étoposide, la vinorelbine) ne peut être exclue. Il est recommandé
d'être prudent et une surveillance supplémentaire peut être appropriée
chez les patients recevant des médicaments métabolisés principalement
ou partiellement par le CYP3A4 (voir rubrique Mises en garde et précautions d'emploi).
Depuis la commercialisation, des évènements de neurotoxicité, un effet
indésirable potentiel de l'ifosfamide, ont été rapportés après une
administration concomitante d'aprépitant et d'ifosfamide.
Immunosuppresseurs
Une
augmentation transitoire modérée, suivie d'une légère diminution de
l'exposition aux immunosuppresseurs métabolisés par le CYP3A4 (tels que
la ciclosporine, le tacrolimus, l'évérolimus et le sirolimus) sont
attendues au cours du traitement de 3 jours administré pour la
prévention des nausées et des vomissements associés à une
chimiothérapie (NVIC). La durée de traitement de 3 jours étant courte,
les variations de l'exposition limitées et fonction du temps, aucune
réduction de la dose de l'immunosuppresseur n'est recommandée pendant
ces 3 jours d'administration concomitante avec EMEND.
Midazolam
Les
effets potentiels des concentrations plasmatiques accrues du midazolam
ou d'autres benzodiazépines métabolisées par le CYP3A4 (alprazolam,
triazolam) doivent être envisagés en cas de co-administration de ces
médicaments avec EMEND (125 mg/80 mg).
EMEND a augmenté l'ASC du midazolam, un substrat sensible du CYP3A4, de 2,3 fois à J1 et de 3,3 fois à J5, lorsqu'une dose orale unique de 2 mg de midazolam a été associée à J1 et à J5 au schéma posologique d'EMEND 125 mg à J1 et 80 mg/jour de J2 à J5.
Dans une autre étude réalisée avec le midazolam par voie intraveineuse, EMEND a été administré à la posologie de 125 mg à J1 et 80 mg/jour à J2 et J3, et 2 mg de midazolam ont été administrés par voie intraveineuse avant l'administration d'EMEND selon le schéma posologique de 3 jours ainsi qu'à J4, J8 et J15. EMEND a augmenté l'ASC du midazolam de 25 % à J4 et a diminué l'ASC du midazolam de 19 % à J8 et de 4 % à J15. Ces effets n'ont pas été considérés comme cliniquement importants.
Dans une troisième étude réalisée avec le midazolam par voie intraveineuse et par voie orale, EMEND a été administré à la posologie de 125 mg à J1 et 80 mg/j à J2 et J3, associé à 32 mg d'ondansétron à J1, à 12 mg de dexaméthasone à J1 et 8 mg de dexaméthasone de J2 à J4. Cette association (c'est-à- dire EMEND, ondansétron et dexaméthasone) a diminué l'ASC du midazolam administré par voie orale de 16 % à J6, 9 % à J8, 7 % à J15 et 17 % à J22. Ces effets n'ont pas été considérés comme cliniquement importants.
Une étude supplémentaire a été réalisée avec administration intraveineuse de midazolam et d'EMEND. 2 mg de midazolam ont été administrés par voie intraveineuse 1 heure après une prise unique d'EMEND 125 mg par voie orale. L'ASC plasmatique du midazolam a été augmentée de 1,5 fois. Cet effet n'a pas été considéré comme cliniquement important.
Induction
En
tant qu'inducteur léger du CYP2C9, du CYP3A4 et de la glucuronidation,
l'aprépitant peut diminuer les concentrations plasmatiques des
substrats éliminés par ces voies au cours des deux semaines suivant la
mise en route du traitement. Cet effet peut n'apparaître qu'après la
fin du traitement de 3 jours par EMEND. Pour les substrats du CYP2C9 et
du CYP3A4, l'induction est transitoire avec un effet maximum atteint 3
à 5 jours après la fin du traitement de 3 jours par EMEND. L'effet
persiste pendant quelques jours, diminue ensuite lentement et est
cliniquement non significatif deux semaines après la fin du traitement
par EMEND. Une induction légère de la glucuronidation est également
constatée avec 80 mg d'aprépitant administrés par voie orale pendant 7
jours. Il n'y a pas de données concernant les effets sur le CYP2C8 et
le CYP2C19. La prudence s'impose lors de l'administration, pendant
cette période, de warfarine, d'acénocoumarol, de tolbutamide, de
phénytoïne ou d'autres substances actives connues pour être
métabolisées par le CYP2C9.
Warfarine
Chez
les patients sous traitement chronique par la warfarine, le temps de
Quick (INR) doit être surveillé étroitement au cours du traitement par
EMEND et pendant les 2 semaines suivant chaque cure de 3 jours d'EMEND
pour la prévention des nausées et vomissements induits par une
chimiothérapie (voir rubrique Mises en garde et précautions d'emploi).
Lors de l'administration d'une dose unique de 125 mg d'EMEND à J1, et
de 80 mg/jour à J2 et J3, à des sujets sains stabilisés traités au long
cours par la warfarine, il n'y a pas eu d'effet d'EMEND sur l'ASC
plasmatique de la R(+) ou de la S(-) warfarine à J3 ; cependant, il y a
eu une réduction de 34 % de la concentration résiduelle de la S(-)
warfarine (un substrat du CYP2C9), accompagnée d'une diminution de 14 %
de l'INR, 5 jours après la fin du traitement par EMEND.
Tolbutamide
EMEND,
administré à la dose de 125 mg à J1 et de 80 mg/jour à J2 et J3, a
abaissé l'ASC du tolbutamide (un substrat du CYP2C9) de 23 % à J4, de
28 % à J8 et de 15 % à J15, lors de l'administration d'une dose orale
unique de 500 mg de tolbutamide avant l'administration d'EMEND selon le
schéma posologique de 3 jours et à J4, J8 et J15.
Contraceptifs hormonaux
L'efficacité
des contraceptifs hormonaux peut être réduite pendant l'administration
d'EMEND et au cours des 28 jours qui la suivent. Des méthodes
alternatives de contraception non hormonale doivent être utilisées au
cours du traitement par EMEND et pendant les 2 mois qui suivent la
dernière prise d'EMEND.
Dans une étude clinique, des doses uniques d'un contraceptif oral contenant de l'éthinylestradiol et de la noréthindrone ont été administrées de J1 à J21 avec EMEND pris selon le schéma posologique de 125 mg à J8 et 80 mg/jour à J9 et J10, associé à 32 mg d'ondansétron par voie intraveineuse à J8 et à la dexaméthasone par voie orale à la posologie de 12 mg à J8 et 8 mg/jour à J9, J10 et J11. Dans cette étude, il y a eu, de J9 à J21, une diminution allant jusqu'à 64 % des concentrations résiduelles d'éthinylestradiol et une diminution allant jusqu'à 60 % des concentrations résiduelles de noréthindrone.
Antagonistes 5-HT3
Au
cours des études cliniques d'interaction, l'aprépitant n'a pas eu
d'effet cliniquement significatif sur la pharmacocinétique de
l'ondansétron, du granisétron ou de l'hydrodolasétron (le métabolite
actif du dolasétron).
Effet d'autres médicaments sur la pharmacocinétique de l'aprépitant
La
co-administration d'EMEND et de substances actives inhibant l'activité
du CYP3A4 (telles que le kétoconazole, l'itraconazole, le voriconazole,
le posaconazole, la clarithromycine, la télithromycine, la néfazodone
et les inhibiteurs de protéase) doit être envisagée avec précaution,
une augmentation de plusieurs fois des concentrations plasmatiques
d'aprépitant étant attendue avec cette association (voir rubrique Mises en garde et précautions d'emploi).
La co-administration d'EMEND et de substances actives induisant fortement l'activité du CYP3A4 (telles que la rifampicine, la phénytoïne, la carbamazépine, le phénobarbital) doit être évitée, une telle association entraînant des diminutions des concentrations plasmatiques de l'aprépitant et donc une diminution de l'efficacité d'EMEND. La co-administration d'EMEND et de préparations à base de plantes contenant du millepertuis (Hypericum perforatum) n'est pas recommandée.
Kétoconazole
Lors
de l'administration d'une dose unique de 125 mg d'aprépitant à J5 d'un
schéma posologique de 10 jours de 400 mg/jour de kétoconazole, un
puissant inhibiteur du CYP3A4, l'ASC de l'aprépitant a augmenté
d'environ 5 fois et la demi-vie terminale moyenne de l'aprépitant a
augmenté d'environ 3 fois.
Rifampicine
Lors
de l'administration d'une dose unique de 375 mg d'aprépitant à J9 d'un
schéma posologique de 14 jours de 600 mg/jour de rifampicine, un
puissant inducteur du CYP3A4, l'ASC de l'aprépitant a diminué de 91 %
et la demi-vie terminale moyenne a diminué de 68 %.
Population pédiatrique
Les études d'interactions ont été réalisées uniquement chez l'adulte.
La suspension buvable doit être préparée et la dose mesurée uniquement par un professionnel de santé.
Posologie
Population pédiatrique
Enfants et nourrissons (âgés de 6 mois à moins de 12 ans, et pesant plus de 6 kg)
EMEND est administré durant 3 jours dans le cadre d'un schéma
thérapeutique comportant un antagoniste 5-HT3. La dose recommandée
d'EMEND poudre pour suspension buvable dépend du poids corporel, comme
spécifié dans le tableau ci-dessous. EMEND est administré par voie
orale une heure avant la chimiothérapie à J1, J2 et J3. Si aucune
chimiothérapie n'est administrée à J2 et J3, EMEND doit être administré
le matin. Voir le Résumé des Caractéristiques du Produit (RCP) de
l'antagoniste 5-HT3 choisi pour des informations sur la posologie
appropriée. Si un corticostéroïde, tel que la dexaméthasone, est
co-administré avec EMEND, la dose de corticostéroïde doit être
administrée à 50 % de la dose habituelle (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques).
Dose de suspension buvable d'EMEND recommandée chez les patients pédiatriques âgés de 6 mois à moins de 12 ans
|
|
Jour 1 | Jour 2 | Jour 3 |
| EMEND suspension buvable 25 mg/mL | 3 mg/kg par voie orale Dose maximale 125 mg | 2 mg/kg par voie orale Dose maximale 80 mg | 2 mg/kg par voie orale Dose maximale 80 mg |
L'efficacité de la poudre pour suspension buvable à 125 mg n'a pas été établie chez les enfants de 12 ans et plus. Pour les adolescents âgés de 12 à 17 ans, EMEND est disponible sous forme de gélules contenant 125 mg ou 80 mg d'aprépitant.
La sécurité d'emploi et l'efficacité d'EMEND poudre pour suspension buvable chez les nourrissons de moins de 6 mois ou pesant moins de 6 kg n'ont pas été établies. Aucune donnée n'est disponible.
Information générale
Les données d'efficacité en association avec d'autres corticostéroïdes
et d'autres antagonistes 5-HT3 sont limitées. Pour plus d'informations
concernant l'administration simultanée avec des corticostéroïdes, voir
rubrique Interactions avec d'autres médicaments et autres formes d'interactions. Se référer au RCP de l'antagoniste 5-HT3 co-administré.
Populations particulières
Sexe
Aucun ajustement posologique n'est nécessaire en fonction du sexe (voir rubrique Propriétés pharmacocinétiques).
Insuffisance rénale
Aucun ajustement posologique n'est nécessaire chez les patients
présentant une insuffisance rénale ou chez les patients présentant une
insuffisance rénale au stade terminal nécessitant une hémodialyse (voir
rubrique Propriétés pharmacocinétiques).
Insuffisance hépatique
Aucun ajustement posologique n'est nécessaire chez les patients ayant
une insuffisance hépatique légère. Les données disponibles chez les
patients ayant une insuffisance hépatique modérée sont limitées, et
aucune donnée chez les patients ayant une insuffisance hépatique sévère
n'est disponible. L'aprépitant doit être utilisé avec précaution chez
ces patients (voir rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacocinétiques).
Mode d'administration
La suspension buvable peut être prise avec ou sans aliments.
Pour les modalités de préparation et d'administration de la suspension, voir la rubrique Précautions particulières d'élimination et de manipulation.
Durée de conservation :
Sachet non ouvert : 2 ans
Après reconstitution : La suspension buvable peut être conservée jusqu'à 3 heures à température ambiante (ne dépassant pas 30°C). Elle peut également être conservée jusqu'à 72 heures au réfrigérateur (entre 2°C et 8°C).
Précautions particulières de conservation :
Ce médicament ne nécessite pas de
précautions particulières de conservation concernant la température. A
conserver dans l'emballage d'origine, à l'abri de l'humidité.
Pour les conditions de conservation après reconstitution, voir la rubrique Durée de conservation.
Sans objet.
En cas de surdosage, EMEND doit être arrêté et des mesures générales symptomatiques ainsi qu'une surveillance clinique doivent être mises en œuvre. En raison de l'activité antiémétique de l'aprépitant, les médicaments provoquant des vomissements peuvent ne pas être efficaces.
L'aprépitant ne peut être éliminé par hémodialyse.
Groupe pharmacothérapeutique : Antiémétiques et antinauséeux, Code ATC : A04AD12
L'aprépitant est un antagoniste sélectif à haute affinité pour les récepteurs de la substance P neurokinine 1 (NK1) humaine.
Traitement de 3 jours par l'aprépitant chez les adultes
Au
cours de deux études randomisées en double aveugle incluant un total de
1 094 patients adultes sous chimiothérapie avec une dose de cisplatine
≥ 70 mg/m2, l'aprépitant en association à un schéma posologique ondansétron/dexaméthasone (voir rubrique Posologie et mode d'administration)
a été comparé à un schéma posologique standard (placebo plus 32 mg
d'ondansétron administré en intraveineux à J1 plus 20 mg de
dexaméthasone par voie orale à J1 et 8 mg par voie orale deux fois par
jour de J2 à J4). Bien qu'une dose intraveineuse de 32 mg d'ondansétron
ait été utilisée dans les études cliniques, celle-ci n'est plus la dose
recommandée. Voir le Résumé des Caractéristiques du Produit de
l'antagoniste 5-HT3 choisi pour plus d'informations sur la posologie appropriée.
L'efficacité a été évaluée sur la base du critère composite suivant : réponse complète (définie par l'absence d'épisodes émétiques et l'absence de recours à un traitement de secours), principalement au cours du cycle 1. Les résultats ont été évalués individuellement pour chaque étude ainsi que pour les 2 études combinées.
Un résumé des résultats clés issus de l'analyse combinée des études est donné dans le Tableau 1.
Tableau 1
Dans
le cadre d'une chimiothérapie hautement émétisante, pourcentage de
patients adultes répondeurs par groupe et phase de traitement - cycle 1
| CRITERES COMPOSITES | Aprépitant (N=521)† % | Traitement standard (N= 524)† % | Différences* % | (IC 95 %) |
| | | | ||
| Réponse complète (pas de vomissements et pas de traitement de secours) | ||||
| Total (0-120 heures) 0-24 heures 25-120 heures | 67,7 86,0 71,5 | 47,8 73.2 51.2 | 19,9 12,7 20,3 | (14,0 ; 25,8) (7,9 ; 17,6) (14,5; 26,1) |
| CRITERES INDIVIDUELS | | | ||
| Pas de vomissements (pas d'épisodes émétiques avec ou sans traitement de secours) | ||||
| Total (0-120 heures) 0-24 heures 25-120 heures | 71,9 86,8 76,2 | 49,7 74,0 53,5 | 22,2 12,7 22,6 | (16,4 ; 28,0) (8,0 ; 17,5) (17,0 ; 28,2) |
| Pas de nausées significatives (VAS max < 25 mm sur une échelle de 0 à 100 mm) | ||||
| Total (0-120 heures) 25-120 heures | 72,1 74,0 | 64.9 66.9 | 7,2 7,1 | (1,6 ; 12,8) (1,5 ; 12,6) |
† Un patient dans le groupe aprépitant a été exclu de l'analyse globale et de celle de la phase retardée, ses données n'étant disponibles que pour la phase aiguë ; un patient recevant le traitement standard a été exclu de l'analyse globale et de celle de la phase aiguë, ses données n'étant disponibles que pour la phase retardée.
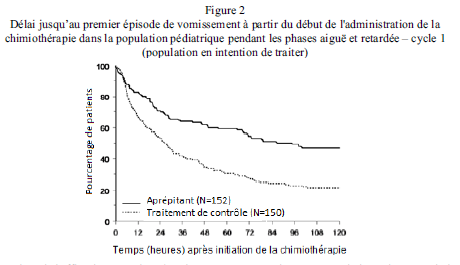
Dans l’analyse combinée, le délai estimé jusqu’au premier vomissement est donné par la courbe de Kaplan-Meier sur la Figure 1.
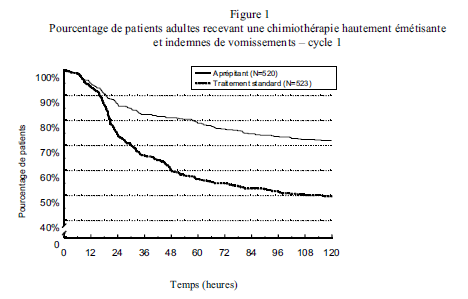
Des différences statistiquement significatives dans l'efficacité ont également été observées individuellement dans chacune des 2 études.
Dans le cadre de ces 2 mêmes études cliniques, 851 patients adultes ont poursuivi une extension de l'évaluation lors des cycles ultérieurs allant jusqu'à 5 cycles supplémentaires de chimiothérapie. L'efficacité du schéma aprépitant s'est apparemment maintenue durant tous les cycles.
Dans une étude randomisée, en double aveugle, réalisée sur un total de 866 patients adultes (864 femmes, 2 hommes) recevant une chimiothérapie comprenant soit du cyclophosphamide 750-1 500 mg/m2, soit du cyclophosphamide 500-1500 mg/m2 et de la doxorubicine (≤ 60 mg/m2) ou de l'épirubicine (≤100 mg/m2), l'aprépitant en association à un traitement ondansétron/dexaméthasone (voir rubrique Posologie et mode d'administration) a été comparé à un traitement standard (placebo plus 8 mg d'ondansétron par voie orale (2 fois à J1 et toutes les 12 heures à J2 et J3) plus 20 mg de dexaméthasone par voie orale à J1).
L'efficacité a été évaluée sur la base du critère composite : réponse complète (définie par l'absence d'épisodes émétiques et l'absence de recours à un traitement de secours), principalement au cours du cycle 1.
Un résumé des résultats clés de l'étude est donné dans le Tableau 2.
Tableau 2
Dans le cadre d'une chimiothérapie moyennement émétisante,
pourcentage de patients adultes répondeurs par groupe et phase de traitement - cycle 1
| | Aprépitant | Traitement standard (N= 424) % | Différences* % | |
| CRITERES COMPOSITES | (N= 433)† | | ||
| | % | (IC 95 %) | ||
| | ||||
| Réponse complète (pas de vomissements et pas de traitement de secours) | ||||
| Total (0-120 heures) | 50,8 | 42,5 49,1 69,0 | 8,3 6,7 6,3 | (1,6; 15,0) |
| 0-24 heures | 75,7 | (0,7 ; 12,7) | ||
| 25-120 heures | 55,4 | (-0,4 ; 13,0) | ||
| CRITERES INDIVIDUELS | ||||
| Pas de vomissements (pas d'épisodes émétiques avec ou sans traitement de secours) | ||||
| Total (0-120 heures) | 75,7 | 58,7 77,3 69,1 | 17,0 10,2 11,7 | (10,8; 23,2) |
| 0-24 heures | 87,5 | (5,1 ; 15,3) | ||
| 25-120 heures | 80,8 | (5,9 ; 17,5) | ||
| Pas de nausées significatives (VAS max < 25 mm sur une échelle de 0 à 100 mm) | ||||
| Total (0-120 heures) | 60,9 | 55,7 78,3 61,5 | 5,3 1,3 3,9 | (-1,3; 11,9) |
| 0-24 heures | 79,5 | (-4,2 ; 6,8) | ||
| 25-120 heures | 65,3 | (-2,6 ; 10,3) | ||
† Un patient dans le groupe aprépitant a été exclu de l'analyse globale et de celle de la phase retardée, ses données n'étant disponibles que pour la phase aiguë.
Dans le cadre de cette même étude clinique, 744 patients adultes ont poursuivi une extension de l'évaluation lors des cycles ultérieurs allant jusqu'à 3 cycles supplémentaires de chimiothérapie. L'efficacité du schéma aprépitant s'est apparemment maintenue durant tous les cycles.
Dans une seconde étude clinique multicentrique, randomisée, en double aveugle, sur des groupes parallèles, l'aprépitant a été comparé au traitement standard chez 848 patients adultes (652 femmes, 196 hommes) recevant une chimiothérapie qui comportait une administration intraveineuse, quelle que soit la dose d'oxaliplatine, de carboplatine, d'épirubicine, d'idarubicine, d'ifosfamide, d'irinotécan, de daunorubicine, de doxorubicine ; du cyclophosphamide par voie intraveineuse (< 1 500 mg/m2) ; ou de la cytarabicine par voie intraveineuse (> 1g/m2). Les patients sous aprépitant recevaient une chimiothérapie pour divers types de tumeurs dont 52 % de cancers du sein, 21 % de canc ers gastro-intestinaux y compris le cancer colorectal, 13 % de cancers pulmonaires et 6 % de cancers gynécologiques. L'aprépitant en association à un traitement ondansétron/dexaméthasone (voir rubrique Posologie et mode d'administration) a été comparé au traitement standard (placebo associé à 8 mg d'ondansétron par voie orale (2 fois à J1 et toutes les 12 heures à J2 et J3) plus 20 mg de dexaméthasone par voie orale à J1).
L'efficacité était basée sur l'évaluation du critère primaire et du principal critère secondaire suivants : pas de vomissements pendant toute la période (de 0 à 120 heures après la chimiothérapie), évaluation de la sécurité d'emploi et de la tolérance de l'aprépitant pour le traitement des nausées et vomissements induits par une chimiothérapie (NVIC) ainsi que la réponse complète (pas de vomissements et pas de traitement de secours) pendant toute la période (0 à 120 heures après la chimiothérapie). De plus, le critère « Pas de nausées significatives pendant toute la période (0-120 heures après la chimiothérapie) » a été évalué à titre exploratoire et dans les phases aiguë et retardée sous forme d'analyse post-hoc.
Un résumé des résultats clés de l'étude est donné dans le tableau 3.
Tableau 3
Dans le cadre d'une chimiothérapie moyennement émétisante,
pourcentage de patients adultes répondeurs par groupe et phase de traitement pour l'étude 2 - cycle 1
| Aprépitant | Traitement standard | Différences* | |
| (N= 425) % | (N= 406) % | % | (IC 95 %) |
| | | ||
| Réponse complète (pas de vomissements et pas de traitement de secours) | |||
| Total (0-120 heures) 68,7 | 56,3 | 12,4 | (5,9 ; 18,9) |
| 0-24 heures 89,2 | 80,3 | 8,9 | (4,0 ; 13,8) |
| 25-120 heures 70,8 | 60,9 | 9,9 | (3,5 ; 16,3) |
| Pas de vomissements (pas d'épisodes émétiques avec ou sans traitement de secours) | |||
| Total (0-120 heures) 76,2 | 62,1 | 14,1 | (7,9 ; 20,3) |
| 0-24 heures 92,0 | 83,7 | 8,3 | (3,9 ; 12,7) |
| 25-120 heures 77,9 | 66,8 | 11,1 | (5,1 ; 17,1) |
| Pas de nausées significatives (VAS max < 25 mm sur une échelle de 0 à 100 mm) | |||
| Total (0-120 heures) 73,6 | 66,4 | 7,2 | (1,0; 13,4) |
| 0-24 heures 90,9 | 86,3 | 4,6 | (0,2 ; 9,0) |
| 25-120 heures 74,9 | 69,5 | 5,4 | (-0,7; 11,5) |
Le bénéfice du traitement par l'aprépitant associé au traitement standard dans la population totale de l'étude est principalement dû aux résultats observés chez les patients faiblement contrôlés par le traitement standard tels que les femmes, même si les résultats sont supérieurs en nombre quels que soient l'âge, le type de tumeur ou le sexe. La réponse complète à l'aprépitant et au traitement standard a été atteinte chez respectivement 209/324 (65 %) et 161/320 (50 %) des femmes et chez 83/101 (82 %) et 68/87 (78 %) des hommes.
Population pédiatrique
Dans une étude clinique randomisée, en double aveugle, contrôlée versus
comparateur actif, réalisée chez 302 enfants et adolescents (âgés de 6
mois à 17 ans) recevant une chimiothérapie moyennement ou hautement
émétisante, le traitement par aprépitant a été comparé à un traitement
contrôle pour la prévention des NVIC. L'efficacité de l'aprépitant a
été évaluée sur un seul cycle (cycle 1). Les patients ont eu la
possibilité de recevoir l'aprépitant en ouvert pour les cycles suivants
(optionnel pour les cycles 2-6) ; cependant l'efficacité n'a pas été
évaluée pour ces cycles optionnels. Le traitement par aprépitant pour
les adolescents âgés de 12 à 17 ans (n = 47) était constitué de gélules
d'EMEND de 125 mg par voie orale à J1 et de 80 mg/jour à J2 et à J3, en
association avec ondansétron à J1. Le traitement par aprépitant pour
les enfants âgés de 6 mois à moins de 12 ans (n = 105) était constitué
de poudre pour suspension buvable d'EMEND à 3,0 mg/kg (jusqu'à 125 mg)
par voie orale à J1 et à 2,0 mg/kg (jusqu'à 80 mg) par voie orale à J2
et à J3, en association avec ondansétron à J1. Le traitement contrôle
chez les adolescents âgés de 12 à 17 ans (n = 48) et les enfants âgés
de 6 mois à moins de 12 ans (n = 102) se composait d'un placebo de
l'aprépitant à J1, J2 et J3, en association avec ondansétron à J1. Les
administrations d'EMEND ou du placebo et d'ondansétron avaient lieu
respectivement 1 heure et 30 minutes avant le début de la
chimiothérapie. L'utilisation de la dexaméthasone par voie
intraveineuse était autorisée dans le cadre du traitement antiémétique
pour les patients pédiatriques dans les deux groupes d'âge, à la
discrétion du médecin. Une réduction de la dose (50 %) de dexaméthasone
était requise chez les patients pédiatriques recevant aprépitant.
Aucune
réduction de dose n'était requise chez les patients pédiatriques
recevant le traitement contrôle. Parmi les patients pédiatriques, la
dexaméthasone faisait partie du traitement au cours du cycle 1 chez 29
% de ceux recevant aprépitant et chez 28 % de ceux recevant le
traitement contrôle.
L'action antiémétique d'EMEND a été évaluée sur une période de 5 jours (120 heures) après l'initiation de la chimiothérapie à J1. Le critère d'évaluation principal était la réponse complète dans la phase retardée (25 à 120 heures après le début de la chimiothérapie) du cycle 1. Un résumé des résultats clés de l'étude est présenté dans le tableau 4.
Tableau 4
Nombre
(%) de patients pédiatriques présentant une réponse complète et aucun
vomissement par groupe de traitement et par phase - cycle 1 (population
en intention de traiter)
| | Traitement par aprépitant n/m (%) | Traitement contrôle n/m (%) |
| CRITERE PRINCIPAL | ||
| Réponse complète* - Phase retardée | 77/152 (50,7) † | 39/150 (26,0) |
| AUTRES CRITERES PREDEFINIS | ||
| Réponse complète* - Phase aiguë | 101/152 (66,4) ‡ | 78/150 (52,0) |
| Réponse complète* - Phases aiguë et retardée | 61/152 (40,1) † | 30/150 (20,0) |
| Pas de vomissementᵟ - Phases aiguë et retardée | 71/152 (46,7) † | 32/150 (21,3) |
| *Réponse complète = Pas de vomissement ni de haut-le-coeur ni de nausées et pas de recours à des traitements de secours. †p < 0,01 par rapport au traitement contrôle ‡p < 0,05 par rapport au traitement contrôle ᵟPas de vomissement = pas de vomissement ni de haut-le-coeur ni de nausées n/m = Nombre de patients présentant une réponse souhaitée / nombre de patients inclus à cet instant. Phase aiguë : 0 à 24 heures après l'initiation de la chimiothérapie. Phase retardée : 25 à 120 heures après l'initiation de la chimiothérapie. Phases aiguë et retardée : 0 à 120 heures après l'initiation de la chimiothérapie. | ||
Le délai estimé jusqu'au premier vomissement après l'initiation de la chimiothérapie était plus long avec le traitement par l'aprépitant (le délai estimé médian jusqu'au premier vomissement était de 94,5 heures) par rapport au groupe de traitement contrôle (le délai estimé médian jusqu'au premier vomissement était de 26,0 heures).
Une analyse de l'efficacité au cycle 1 dans les sous-groupes a démontré que, indépendamment de la catégorie d'âge, du sexe, de l'utilisation de la dexaméthasone pour la prophylaxie antiémétique, et du potentiel émétogène de la chimiothérapie, le traitement par aprépitant a permis un meilleur contrôle que le traitement contrôle selon les critères d'évaluation de réponse complète.
L'aprépitant présente une pharmacocinétique non linéaire. La clairance et la biodisponibilité absolue diminuent toutes deux avec l'augmentation de la dose.
Absorption
La biodisponibilité absolue moyenne de l'aprépitant par voie orale est
de 67 % pour la gélule de 80 mg et de 59 % pour la gélule de 125 mg. Le
pic moyen de concentration plasmatique (Cmax) de l'aprépitant est
survenu aux environs de la 4ème heure (tmax). L'administration orale de
la gélule avec un petit déjeuner standard d'environ 800 Kcal a entraîné
une augmentation de 40 % de l'ASC de l'aprépitant. Cette augmentation
n'est pas jugée pertinente sur le plan clinique.
La pharmacocinétique de l'aprépitant est non linéaire sur l'éventail des doses cliniques. Chez le jeune adulte sain, l'augmentation de l'ASC0- a été de 26 % supérieure à la proportionnalité de la dose, pour des doses uniques de 80 et de 125 mg administrées non à jeun.
Après administration orale d'une dose unique de 125 mg d'EMEND à J1 et de 80 mg une fois par jour à J2 et J3, l'ASC0-24h (moyenne ± ET) a été de 19,6 ± 2,5 µg•h/mL et de 21,2 ± 6,3 µg•h/mL à J1 et J3 respectivement. La Cmax a été de 1,6 ± 0,36 µg/mL et de 1,4 ± 0,22 µg/mL à J1 et J3 respectivement.
Distribution
L'aprépitant se lie fortement aux protéines, avec une moyenne de 97 %.
La moyenne géométrique du volume apparent de distribution à l'état
d'équilibre (Vdss) est d'environ 66 L chez l'homme.
Biotransformation
L'aprépitant subit un métabolisme important. Chez le jeune adulte sain,
l'aprépitant représente environ 19 % de la radioactivité mesurée au
niveau du plasma durant les 72 heures qui suivent l'administration
d'une dose intraveineuse unique de 100 mg de fosaprépitant, une
prodrogue de l'aprépitant, marqué au [14C], ce qui indique une présence
substantielle de métabolites au niveau du plasma. Douze métabolites de
l'aprépitant ont été identifiés dans le plasma humain. Le métabolisme
de l'aprépitant intervient largement via l'oxydation au niveau du cycle
de la morpholine et de ses chaînes latérales, les métabolites qui en
résultent n'étant que faiblement actifs. Les études réalisées in
vitro sur des microsomes hépatiques humains indiquent que l'aprépitant
est tout d'abord métabolisé au niveau du CYP3A4, et potentiellement
dans une moindre proportion par les CYP1A2 et CYP2C19.
Elimination
L'aprépitant n'est pas excrété sous forme inchangée dans les urines.
Les métabolites sont excrétés dans les urines et, par voie biliaire,
dans les fèces. Après administration à des sujets sains d'une dose
intraveineuse unique de 100 mg de fosaprépitant, une prodrogue de
l'aprépitant, marqué au [14C], 57 % de la radioactivité ont été
récupérés dans les urines et 45 % dans les fèces.
La clairance plasmatique de l'aprépitant est dose-dépendante et décroît avec l'augmentation de la dose, allant de 60 à 72 mL/min environ dans la fourchette des doses thérapeutiques. La demi-vie terminale varie d'environ 9 à 13 heures.
Pharmacocinétique chez des populations particulières
Sexe : Après administration orale d'une dose unique de 125 mg
d'aprépitant, la Cmax de l'aprépitant a été supérieure de 16 % chez les
femmes comparées aux hommes. La demi-vie de l'aprépitant a été
inférieure de 25 % chez les femmes comparées aux hommes, et son tmax
survient approximativement au même moment. Ces différences ne sont pas
considérées comme étant cliniquement significatives. Aucun ajustement
posologique d'EMEND n'est nécessaire en fonction du sexe.
Insuffisance hépatique : Une insuffisance hépatique légère (classe A de Child-Pugh) n'affecte pas la pharmacocinétique de l'aprépitant de façon cliniquement significative. Aucun ajustement posologique n'est nécessaire chez les patients en insuffisance hépatique légère. On ne peut pas tirer de conclusions concernant l'influence d'une insuffisance hépatique modérée (classe B de Child-Pugh) sur la pharmacocinétique de l'aprépitant à partir des données actuellement disponibles. On ne dispose d'aucune donnée clinique ni pharmacocinétique chez des patients en insuffisance hépatique sévère (classe C de Child-Pugh).
Insuffisance rénale : Une dose unique de 240 mg d'aprépitant a été administrée à des patients en insuffisance rénale sévère (ClCr < 30 mL/min) et à des patients atteints de néphropathie à un stade terminal nécessitant une hémodialyse.
Chez les patients en insuffisance rénale sévère, l'ASC0- de l'aprépitant total (lié ou non aux protéines) a diminué de 21 % et la Cmax a diminué de 32 % comparées à des sujets sains. Chez les patients atteints de néphropathie à un stade terminal et sous hémodialyse, l'ASC0- de l'aprépitant total a diminué de 42 % et la Cmax a diminué de 32 %. En raison d'une baisse modeste de la liaison protéique de l'aprépitant chez les patients atteints de néphropathie, l'ASC de l'aprépitant non lié et pharmacologiquement actif n'est pas affectée de façon significative chez les patients insuffisants rénaux comparés aux sujets sains. Une hémodialyse réalisée entre 4 et 48 heures après la prise n'a eu aucun effet significatif sur la pharmacocinétique de l'aprépitant ; moins de 0,2 % de la dose a été récupéré au niveau du dialysat.
Aucun ajustement posologique d'EMEND n'est nécessaire chez les patients en insuffisance rénale ni chez les patients atteints d'une néphropathie à un stade terminal sous hémodialyse.
Population pédiatrique : Dans le cadre d'un schéma thérapeutique de 3 jours, l'administration des gélules d'aprépitant (125/80/80 mg) chez des patients adolescents (âgés de 12 à 17 ans) a conduit à une ASC0-24h supérieure à 17 µg•h/mL à J1 avec des concentrations (Cmin) à l'issue de J2 et J3 supérieures à 0,4 µg/mL chez une majorité de patients. Le pic de concentration plasmatique (Cmax) médian était d'environ 1,3 µg/mL à J1, atteint au bout de 4 heures environ. Dans le cadre d'un schéma thérapeutique de 3 jours, l'administration d'aprépitant en poudre pour suspension buvable (3/2/2 mg/kg) chez des patients âgés de 6 mois à moins de 12 ans a conduit à une ASC0-24h supérieure à 17 µg•h/mL à J1 avec des concentrations (Cmin) à l'issue de J2 et J3 supérieures à 0,1 µg/mL chez une majorité de patients. Le pic de concentration plasmatique (Cmax) médian était d'environ 1,2 µg/mL à J1, atteint entre 5 et 7 heures.
Une analyse pharmacocinétique de population de l'aprépitant chez des patients pédiatriques (âgés de 6 mois à 17 ans) suggère que le sexe et l'origine ethnique n'ont aucun effet cliniquement significatif sur la pharmacocinétique de l'aprépitant.
Relation effet/dose
A l'aide d'un traceur hautement spécifique du récepteur de la NK1, des
études par tomographie par émission de positrons (TEP) menées auprès de
jeunes hommes sains ont montré que l'aprépitant pénètre dans le cerveau
et se lie aux récepteurs de la NK1 de façon dose et concentration
plasmatiques dépendante. Les concentrations plasmatiques de
l'aprépitant obtenues avec le schéma posologique de 3 jours d'EMEND
chez les adultes permettent d'envisager un taux de liaison aux
récepteurs cérébraux de la NK1 supérieur à 95 %.
EMEND peut avoir une influence mineure sur l'aptitude à faire du vélo et à utiliser des machines. Des étourdissements et une fatigue peuvent survenir après la prise d'EMEND (voir rubrique Effets indésirables).
Les données précliniques ne révèlent aucun risque particulier pour l'homme, sur la base des études conventionnelles de toxicité à dose unique et à doses répétées, de génotoxicité, du potentiel cancérigène, de toxicité sur la fonction de reproduction et le développement. Toutefois, il convient de noter que l'exposition systémique chez des rongeurs a été comparable voire inférieure à l'exposition chez l'homme à des doses thérapeutiques de 125 mg/80 mg. En particulier, bien qu'aucun effet indésirable n'ait été noté lors des études sur la fonction de reproduction à des niveaux d'exposition humaine, les expositions chez l'animal ne sont pas suffisantes pour permettre une évaluation adéquate du risque chez l'homme.
Dans
une étude de toxicité juvénile chez des rats traités entre le 10ème et
le 63ème jour après la naissance, l'aprépitant a entrainé une ouverture
vaginale prématurée chez les femelles à partir de la dose de 250 mg/kg
2 fois par jour, et une séparation retardée du prépuce chez les mâles à
partir de la dose de 10 mg/kg 2 fois par jour. Il n'y avait pas de
marge de sécurité pour une exposition clinique pertinente. Aucun effet
lié au traitement sur l'accouplement, la fertilité ou la survie
embryonnaire/fœtale, ni aucune modification pathologique des organes
reproducteurs n'ont été observés. Dans une étude de toxicité juvénile
chez les chiens traités entre le 14ème et le 42ème jour après la
naissance, une diminution du poids des testicules et de la taille des
cellules de Leydig a été observée chez les mâles à la dose de 6
mg/kg/jour, et une augmentation du poids de l'utérus, une hypertrophie
de l'utérus et du col de l'utérus, ainsi qu'un œdème des tissus
vaginaux ont été observés chez les femelles à la dose de 4 mg/kg/jour.
Il n'y avait pas de marge de sécurité pour une exposition clinique
pertinente à l'aprépitant. Pour un traitement à court terme et à la
posologie recommandée, la pertinence clinique de ces observations est
considérée comme peu probable.
Le contenu de
chaque sachet à usage unique doit être mis en suspension dans 4,6 mL d'eau pour obtenir une concentration finale de 25 mg par
mL.
· Pour plus de détails sur la préparation et l'administration de la suspension, voir la notice et les instructions pour les professionnels de santé au sujet de la préparation de la suspension buvable.
· Utilisez la pipette de 5mL pour mesurer 4,6 mL d'eau avant de la verser dans le godet mélangeur.
· Versez la totalité du contenu du sachet dans les 4,6 mL d'eau et mélangez.
· Une fois mélangée, mesurez le volume recommandé (dose) de suspension à l'aide de la pipette. Choisissez la pipette correspondant à la dose. Utilisez la pipette de 1 mL si la dose est égale ou inférieure à 1 mL et utilisez la pipette de 5 mL si la dose est supérieure à 1 mL. Administrez la dose par voie orale. Si la dose n'a pas été administrée immédiatement après la mesure, la pipette remplie peut être réfrigérée (entre 2°C et 8°C) pendant maximum 72 heures avant l'utilisation.
· La suspension peut être conservée à température ambiante (ne dépassant pas 30°C) jusqu'à 3 heures, avant l'administration.
· La suspension non utilisée et tout autre déchet doivent être jetés.
· Pour plus de détails sur la préparation et l'administration de la suspension, voir la notice et les instructions pour les professionnels de santé au sujet de la préparation de la suspension buvable.
· Utilisez la pipette de 5mL pour mesurer 4,6 mL d'eau avant de la verser dans le godet mélangeur.
· Versez la totalité du contenu du sachet dans les 4,6 mL d'eau et mélangez.
· Une fois mélangée, mesurez le volume recommandé (dose) de suspension à l'aide de la pipette. Choisissez la pipette correspondant à la dose. Utilisez la pipette de 1 mL si la dose est égale ou inférieure à 1 mL et utilisez la pipette de 5 mL si la dose est supérieure à 1 mL. Administrez la dose par voie orale. Si la dose n'a pas été administrée immédiatement après la mesure, la pipette remplie peut être réfrigérée (entre 2°C et 8°C) pendant maximum 72 heures avant l'utilisation.
· La suspension peut être conservée à température ambiante (ne dépassant pas 30°C) jusqu'à 3 heures, avant l'administration.
· La suspension non utilisée et tout autre déchet doivent être jetés.
Tout médicament non utilisé ou déchet doivent être éliminés conformément à la réglementation en vigueur.
Liste I.
Médicament d'exception.
Médicament d'exception.
Poudre pour suspension buvable.
Poudre rose à rose clair.
Sachet en PET/aluminium/PEBDL.
Boîte à usage unique.
Chaque
boîte contient un sachet de poudre pour suspension buvable, une pipette
de 1 mL et une pipette de 5 mL (polypropylène avec joint torique en
silicone), un capuchon, et un godet mélangeur (polypropylène).
Chaque sachet contient 125 mg d'aprépitant. Après reconstitution, 1 mL de suspension buvable contient 25 mg d'aprépitant.
Excipients à effet notoire
Chaque sachet contient environ 125 mg de saccharose et 468,7 mg de lactose (anhydre).
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Hydroxypropylcellulose (E 463)
Laurilsulfate de sodium
Saccharose
Lactose (anhydre)
Oxyde de fer rouge (E 172)
Fumarate de stéaryle sodique